Việt Nam có thể sản xuất 280 triệu viên Molnupiravir/tháng
(THPL) - Hiện nay, Cục Quản lý dược (Bộ Y tế) đã cấp Giấy phép lưu hành sản phẩm và công bố giá 3 loại thuốc có hoạt chất Molnupiravir do Việt Nam sản xuất. Theo đó, năng lực sản xuất thuốc Molnupiravir điều trị COVID-19 của 3 đơn vị trong nước có thể đạt 280 triệu viên/tháng, tương ứng với 11 triệu liệu trình/tháng.
Liên quan đến thuốc Molupiravir điều trị COVID-19, tính tới thời điểm hiện tại, Cục Quản lý Dược đã cấp phép nhập khẩu 37.610.540 viên Molnupiravir để phục vụ cho nghiên cứu khoa học, nghiên cứu thử nghiệm lâm sàng (khoảng 940.000 liệu trình điều trị).
Báo Hà Nội mới đưa tin, theo số liệu tính toán của Cục Quản lý khám chữa bệnh (Bộ Y tế), số ca mắc COVID-19 mức độ nhẹ là khoảng 1.116.000 ca/tháng. Ước tính 30% số bệnh nhân này phải dùng thuốc kháng vi rút. Nếu dùng toàn bộ Molnupiravir thì nhu cầu là 334.800 liệu trình/tháng. Hiện, năng lực sản xuất thuốc trong nước hoàn toàn có thể đáp ứng nhu cầu điều trị.
Tổng công suất sản xuất thuốc Molnupiravir của 3 đơn vị được cấp phép có thể đạt 280 triệu viên/tháng, tương ứng với 11 triệu liệu trình/tháng. Giá thành hiện tại cho 1 liệu trình điều trị khoảng 300.000 đồng (rẻ nhất so với các nước khác trên thế giới).
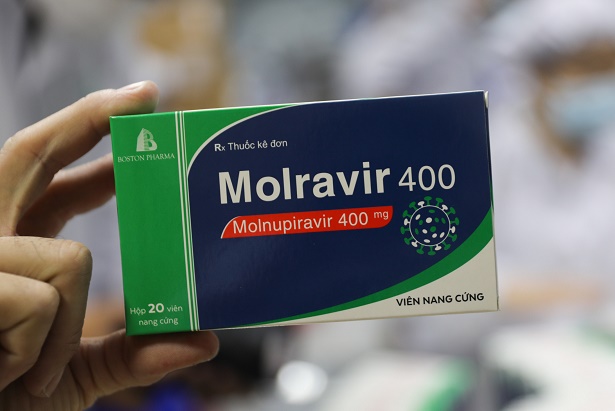
Theo báo VTC News, trước đó ngày 17/2, Bộ Y tế (Cục Quản lý Dược) ký quyết định ban hành danh mục 3 loại thuốc chứa Molnupiravir sản xuất trong nước, được cấp giấy đăng ký lưu hành tại Việt Nam.
Ba loại thuốc được cấp phép gồm: Molravir 400 của Công ty Cổ phần Dược phẩm Boston Việt Nam; Movinavir hàm lượng 200mg của Công ty Cổ phần Hóa - dược phẩm Mekorpha và Molnupiravir Stella 400 của Công ty TNHH Stellapharm. Quyết định cấp phép khẩn cấp thuốc Molnupiravir của Cục Quản lý Dược dựa trên cơ sở đề xuất của Hội đồng tư vấn cấp giấy phép lưu hành thuốc và nguyên liệu làm thuốc.
Ba điều kiện đi kèm với đề xuất cấp phép khẩn cấp là doanh nghiệp phải kiểm tra chất lượng nguyên liệu đạt yêu cầu trước khi sản xuất; tiếp tục theo dõi, kiểm tra chất lượng thuốc hàng tháng sau khi được cấp giấy đăng ký lưu hành và báo cáo cơ quan quản lý để giám sát chặt chẽ về chất lượng, tuổi thọ của thuốc; tiếp tục nghiên cứu độ ổn định của thuốc và nộp dữ liệu nghiên cứu, hồ sơ cập nhật hạn dùng để thẩm định theo hướng dẫn và yêu cầu của Bộ hồ sơ kỹ thuật chung ASEAN.
Molnupiravir là hoạt chất có tác dụng kháng virus, được xem là "vũ khí" quan trọng trong điều trị F0 tại nhà. Thuốc có tác dụng giảm tải lượng virus khi sử dụng ở giai đoạn đầu mắc bệnh, từ đó giảm nguy cơ trở nặng và tử vong. Thuốc dạng viên, dùng theo đường uống, thuận tiện cho F0 tại nhà.
Về tiêm chủng, thống kê trên Cổng thông tin tiêm chủng COVID-19 đến 14h ngày 7/3 cho biết cả nước đã tiêm hơn gần 198 triệu liều vaccine phòng COVID-19, trong đó ngày 6/3, cả nước tiêm 338.819 liều vaccine.
Số vaccine phòng COVID-19 đã tiêm cho người từ 18 tuổi trở lên tính đế là 180.547.272 liều, trong đó Mũi 1: 70.857.344 liều; Mũi 2: 69.136.857 liều; Mũi bổ sung: 14.213.253 liều; Mũi 3: 26.339.818 liều
Đến nay 62/63 tỉnh, thành phố có tỷ lệ bao phủ mũi 2 mũi 2 vaccine phòng COVID-19 trên 90%; chỉ còn duy nhất 01/63 tỉnh, thành phố có tỷ lệ bao phủ mũi 2 dưới 90%.
Về số vaccine phòng COVID-19 tiêm cho trẻ từ 12-17 tuổi là 17.024.262 liều, trong đó mũi 1: 8.741.252 liều; Mũi 2: 8.283.010 liều.
Đến nay đã có 57/63 tỉnh, thành phố có tỷ lệ bao phủ mũi 2 vaccine phòng COVID-19 trên 90%; Chỉ còn 6/63 tỉnh, thành phố có tỷ lệ bao phủ mũi 2 dưới 90%.
Phương Linh (tổng hợp)
Tin khác

Việt Nam quan ngại sâu sắc về xung đột theo thang tại Trung Đông

Đại sứ quán Việt Nam tại Israel ra khuyến cáo khẩn tới cộng đồng người Việt

Chấp thuận chủ trương đầu tư dự án đường dây 220 kV Trạm cắt 220 kV Đa Nhim - Đức Trọng - Di Linh

Quyết liệt gỡ điểm nghẽn số hoá trong các cơ quan Đảng

Bí thư Lào Cai làm Thứ trưởng Thường trực Bộ Nông nghiệp và Môi trường

Thủ tướng: Nếu thể chế kiến tạo là "đường ray" thì năng lực quản trị chính là "đầu tàu"
Ông Mai Tiến Dũng giới thiệu doanh nghiệp cho nguyên Bộ trưởng Kim Tiến
Ông Mai Tiến Dũng khi giữ chức vụ Bí thư Tỉnh ủy Hà Nam đã giới thiệu một doanh nghiệp đến gặp bị can Nguyễn Thị Kim Tiến (cựu Bộ...28/02/2026 13:02:094 ô tô va chạm liên hoàn gây ùn tắc trên cao tốc Pháp Vân - Cầu Giẽ
Sáng 28.2, tại khu vực trạm thu phí cao tốc Pháp Vân – Cầu Giẽ (Hà Nội) xảy ra vụ tai nạn giao thông liên hoàn.28/02/2026 12:56:16Giám đốc Đại học Quốc gia Hà Nội Hoàng Minh Sơn được giao Quyền Bộ trưởng Bộ GD-ĐT
Ông Hoàng Minh Sơn, Chủ tịch Hội đồng, Giám đốc Đại học Quốc gia Hà Nội, được Thủ tướng giao quyền Bộ trưởng Bộ Giáo dục và Đào...28/02/2026 11:50:46Bất động sản sắp có mã định danh, việc mua bán thay đổi thế nào?
Khi mỗi bất động sản sẽ được gắn một mã định danh điện tử quy trình mua bán nhà đất cũng sẽ có nhiều điểm mới.28/02/2026 11:39:00
ĐỌC NHIỀU NHẤT
Quảng bá thương hiệu Việt
-

Tăng cường quảng bá sản phẩm, thương hiệu địa phương tại Hội chợ Mùa Xuân lần thứ nhất năm 2026
- Triển lãm “Đạo học ngàn năm” tôn vinh truyền thống hiếu học của dân...
- Tháo gỡ “điểm nghẽn” để ngành kim hoàn - đá quý Việt Nam cất cánh
- Vinh danh Nghệ nhân “Bàn tay vàng” và phong tặng Nghệ nhân Quốc gia






